L'intégrité du génome est constamment menacée par des dommages de l'ADN provenant de sources endogènes et environnementales. Si elles ne sont pas réparées rapidement, les lésions de l'ADN peuvent bloquer la réplication de l'ADN et entraîner un stress réplicatif, l'instabilité du génome et finalement la tumorigenèse. Par ailleurs, le traitement du cancer implique des agents thérapeutiques endommageant l'ADN tels que le cisplatine et les rayonnements ionisants qui provoquent un stress réplicatif. Toxique pour les cellules à croissance incontrôlée, le stress réplicatif est donc exploité à des fins thérapeutiques pour tuer les cellules cancéreuses. Cependant, l'un des principaux défis dans le traitement du cancer reste l'acquisition de résistances. Notre objectif est de comprendre comment les cellules gèrent le stress réplicatif et son impact sur la stabilité du génome et de l'épigénome ainsi que sur la sensibilité aux dommages de l'ADN causés par des sources environnementales et des traitements contre le cancer.
Les cellules ont développé des mécanismes pour répondre au stress réplicatif en tolérant les dommages de l'ADN (Fig. 1). Ces mécanismes assurent, d'une part, la viabilité cellulaire dans des conditions de stress réplicatif. D'autre part, étant potentiellement mutagènes, ils peuvent contribuer à la carcinogenèse ainsi qu'à l'acquisition d'une résistance aux traitements anticancéreux endommageant l'ADN.
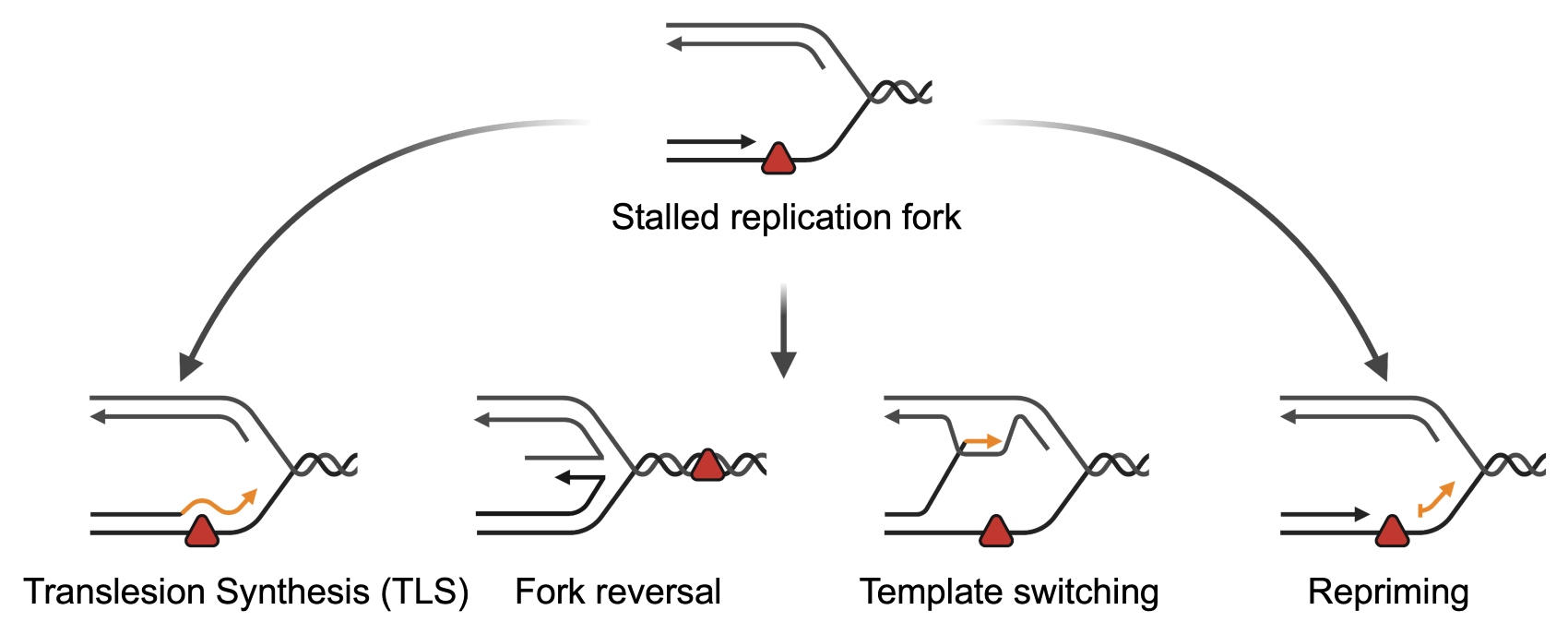
|
Fig. 1 Mécanismes de tolérance des dommages de l'ADN (Adapté de Quinet et al., 2021, crédit Dr. Meroni)
|
Grâce au développement de nouvelles approches à molécule unique basées sur le test des fibres d'ADN (Fig. 2), nous avons découvert que les cellules humaines utilisent fréquemment le mécanisme de Repriming pour répondre au stress réplicatif, au détriment de l'accumulation des lacunes d'ADN simple brin post-réplicatif (ssDNA gaps) (Quinet et al., 2016, 2020). Nous avons également commencé à déchiffrer les bases moléculaires des mécanismes de remplissage des lacunes (gap filling) dans les cellules humaines et leur impact sur la stabilité du génome et la sensibilité cellulaire aux agressions environnementales et au traitement du cancer (Quinet et al., 2016, Tirman, Quinet et al., 2021).
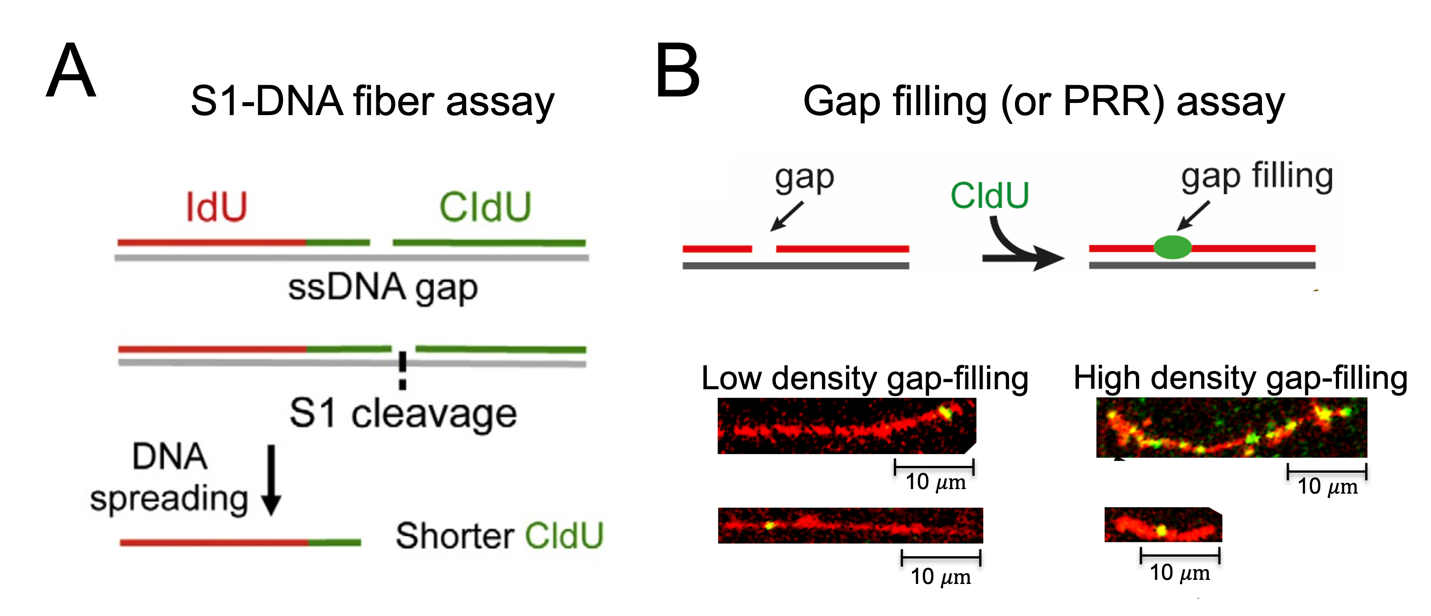
|
Fig. 2 Approches de microcopie à molécule unique basées sur le test de fibres d'ADN pour étudier la formation et la réparation des lacunes post-réplicatives d'ADN simple brin (ssDNA gaps). (A) Essai de fibres d'ADN modifié par la S1. L'utilisation de la nucléase S1 spécifique à l'ADN simple brin sur le test de fibres d'ADN permet la détection de ssDNA gaps indétectables par les protocoles de fibres d'ADN classique en générant des fibres plus courtes. (B). Test de remplissage des lacunes (gap filling) ou de réparation post-réplicative (PRR). Un analogue de la thymidine est ajouté au milieu de culture cellulaire pour être incorporé lors du gap filling, permettant la visualisation et la quantification de ces événements. Images adaptées de Martins, Tirman et al., 2022.
|
En recoupant nos approches précédemment établies avec la microscopie de pointe, la protéomique et le séquençage de nouvelle génération sur des modèles humains, nous visons désormais à :
- Définir les étapes moléculaires de la formation et de la réparation des ssDNA gaps,
- Élucider les interactions entre les ssDNA gaps et la dynamique de la chromatine,
- Étudier la réponse au stress réplicatif induit par les rayonnements ionisants et son impact sur la réponse des cellules cancéreuses à la radiothérapie.
Notre objectif à long terme est de déterminer si l'expression de facteurs clés de réponse au stress réplicatif peut être prédictive de la réponse des cellules cancéreuses au traitement, et d'identifier de nouvelles stratégies pour améliorer les traitements actuels contre le cancer et surmonter la résistance acquise.
Nos projets en cours sont financés par le programme ATIP-Avenir (depuis le 01/01/2023), EDF (en collaboration avec l'équipe du Dr Anna Campalans) et un package Startup pour nouveau chef de groupe de l'UMRE008/IRCM/IBFJ/CEA.