La méthylation de l'ADN est une marque épigénétique associée à la régulation des gènes. Elle joue un rôle clé dans un certain de nombre de processus biologiques comme l'embryogenèse, le vieillissement, la carcinogenèse ou encore l'immunité dans les maladies infectieuses.
Chez les mammifères, elle consiste en une modification chimique reposant sur l'ajout d'un groupement CH3 sur une des bases nucléotidiques la cytosine, réaction qui est catalysée par deux grandes classes d'ADN méthyltransférases.
La méthylation est principalement retrouvée sur les motifs CpG (dans lesquels p désigne le phosphate qui lie les deux bases C et G) en raison de leur caractère symétrique. Pour une investigation à l'échelle du génome entier, différentes techniques (enzymatique, immunologique ou chimique) peuvent être combinées à des méthodes d'hybridation sur puces ou de séquençage à haut débit pour une résolution plus détaillée.
La caractérisation chimique du statut de méthylation à l'échelle de la cytosine repose sur l'utilisation du bisulfite de sodium. En présence de ce composé, les cytosines sont converties en uracile, alors que les cytosines méthylées ne sont pas affectées. L'ADN converti peut ainsi être hybridé sur des puces permettant, en raison du coût avantageux, une couverture du génome de plusieurs échantillons en parallèle dans le cadre d'études pangénomiques de larges cohortes. Parmi les puces les plus utilisées, les puces Infinium Human Methylation450 BeadChip (Illumina) et Methylation EPIC BeadChips (Illumina) permettent d'étudier l'état de méthylation de plusieurs centaines de milliers de CpG dans tout le génome humain.
En raison de leur proximité phylogénétique avec l'Homme, les Primates Non Humains (PNHs) sont des modèles d'étude de choix utilisés en recherche biomédicale. Mais peu d'outils spécifiquement dédiés à l'analyse du génome entier sont actuellement disponibles pour ces modèles simiens.
C'est dans ce contexte que le Laboratoire d''Epigénétique et d'Environnement du CNRGH, en collaboration avec l'Unité Inflammation et Persistance du VIH de l'Institut Pasteur et le département IDMIT, a mené deux études portant d'une part sur l'évaluation des puces Infinium Human Methylation450 (Illumina) et Methylation EPIC BeadChips (Illumina) sur l'analyse de la méthylation chez les PNHs et d'autre part présentant un exemple d'application dans un modèle d'infection au VIS (virus d'immunodéficience simienne).
La première étude publiée dans la revue Epigenomics, a permis d'évaluer les sondesa de ces deux puces utilisées classiquement pour l'analyse de la méthylation de l'ADN humain, chez deux espèces simiennes, les macaques rhésus d'Asie (Macaca mulatta) et les singes verts d'Afrique (Chlorocebus sabaeus). Cette première étude a donné lieu à une réannotation précise des sondes facilitant ainsi les analyses de méthylation d'ADN à haut débit pour ces deux espèces.
Dans la deuxième étude, publiée dans la revue Clinical Epigenetics, ces nouveaux outils ont été utilisés pour caractériser l'impact de la méthylation sur des infections pathogènes chez les macaques rhésus d'Asie (Macaca mulatta) et des infections non pathogènes chez les singes verts d'Afrique (Chlorocebus sabaeus) par le virus de l'immunodéficience simienne (VIS). Le VIS est un rétrovirus ayant de nombreuses souches et ciblant exclusivement une quarantaine d'espèces simiennes. Il est l'équivalent de l'agent étiologique (VIH) responsable du SIDA chez l'Homme.
Pour rappel, les primates non humains (PNHs) africains, tels que les singes verts (Chlorocebus sabaeus), sont les hôtes naturels du VIS, ils présentent des niveaux élevés de charge virale dans le sang et l'intestin mais ne présentent pas d'activation immunitaire chronique ni d'évolution vers les symptômes cliniques de la maladie. Après avoir mis en place une réponse immunitaire aiguë contre le VIS lors de la primo-infection, les hôtes naturels régulent à la baisse l'activation immunitaire induite par le VIS. Ce contrôle de l'activation immunitaire est maintenu pendant toute la durée de leur vie, ce qui suggère un mécanisme actif, efficace et durable. De plus, contrairement à l'Homme ou au macaque rhésus, les hôtes naturels comme les singes verts africains maintiennent un équilibre du nombre de lymphocytes T CD4+b.
Les chercheurs de cette étude ont donc émis l'hypothèse que des modifications épigénétiques spécifiques pouvaient contribuer à maintenir ce contrôle à long terme. Ils ont pour cela analysé en utilisant les puces Infinium Human Methylation450 BeadChip (Illumina) les modifications de la méthylation de l'ADN en réalisant un suivi post-infection par le VIS dans une cohorte de singes verts africains (ciblant spécifiquement les cellules T CD4+ des ganglions lymphatiquesc et du sang) en comparaison à une cohorte de macaques rhésus d'Asie.
Les modifications de la méthylation de l'ADN post-infection VIS étaient plus prononcées dans les ganglions lymphatiques que dans le sang et ont été détectées dès la phase de primo-infection.
Suite à l'infection pathogène par le VIS chez le macaque rhésus asiatique (développant les symptômes cliniques), une augmentation du nombre des gènes méthylés impliqués dans une voie de signalisation pro-inflammatoire (voie Th1) a été notée. En revanche l'infection non pathogène chez le singe vert africain induit une méthylation de gènes codant pour des protéines contribuant à une réaction inflammatoire modérée voire moindre et au maintien de l'intégrité des tissus du modèle infecté. De plus, l'infection pathogène chez le macaque rhésus asiatique induit des changements de méthylation de l'ADN liés à des changements fonctionnels dans le métabolisme et l'activation immunitaire siégeant au sein des ganglions lymphatiques.
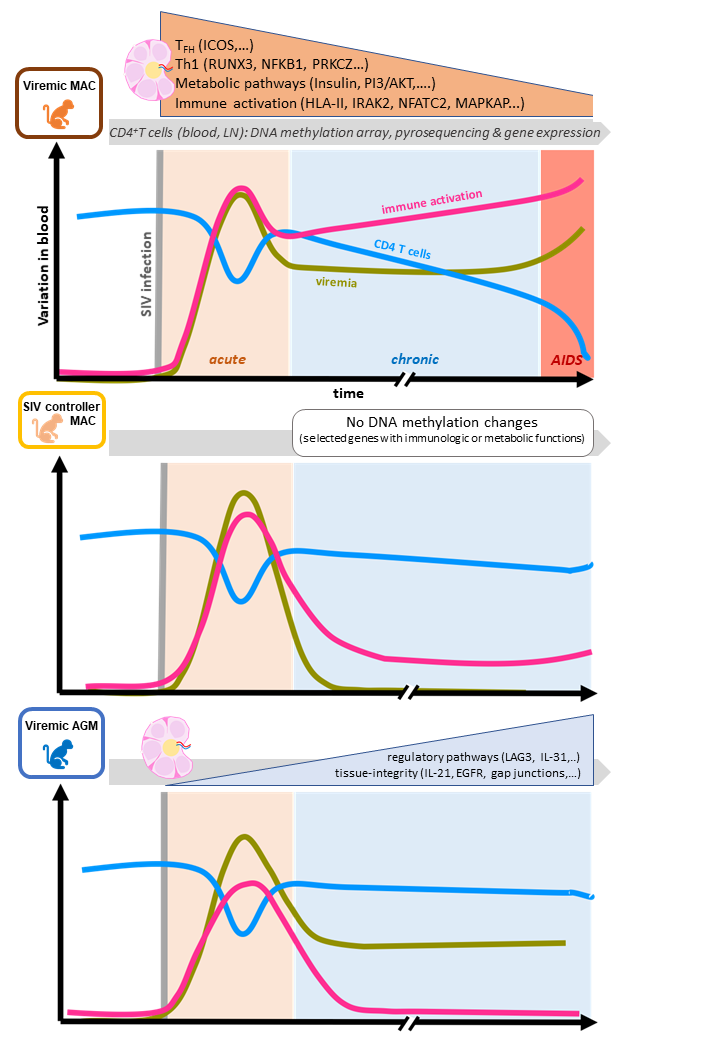
Ces travaux ont permis d'identifier grâce aux puces Infinium Human Methylation450 BeadChip (Illumina) des gènes clés, méthylés différentiellement dès la primo-infection et dans les tissus spécifiques, pouvant contribuer à la persistance des troubles métaboliques et de l'inflammation dans les modèles simiens d'infection pathogène.
Ces gènes pourraient représenter de nouvelles cibles pour développer des traitements complémentaires chez les personnes infectées par le VIH mais échappant à la trithérapie classique.
L'application des outils développés dans le cadre de ces travaux pourrait également être utilisée pour étudier les changements épigénétiques dans d'autres maladies infectieuses telles que la Covid-19 dans des modèles d'étude de type PNHs.
a : Une puce à ADN est un support rigide sur lequel de courtes séquences d'ADN ont été déposées. Ces courtes séquences sont des "sondes" correspondant à des oligonucléotides de synthèse. Les sondes ont la particularité d'avoir été choisies de manière à être spécifique d'un seul et unique gène. Ce microdispositif est mis au contact des acides nucléiques à analyser.
b : Les lymphocytes T CD4+, connus également sous le terme de lymphocytes auxiliaires sont des cellules du système immunitaire dont la prolifération permet de diriger et d'activer d'autres cellules pour l'élimination de l'agent pathogène. Ces cellules constituent la cible privilégiée de l'agent étiologique du SIDA, le VIH, qui s'y multiplie intensément au cours de la phase aiguë de la maladie.
c : Les ganglions lymphatiques sont des réservoirs principaux de virus actifs lors de la phase asymptomatique de la maladie.