Le rôle fondamental du système immunitaire passe par le maintien d'une surveillance continue qui implique l'activation coordonnée des cellules immunitaires innées et adaptatives. Le développement d'un cancer (transformation néoplasique) incite le système immunitaire à s'activer et à éliminer la tumeur.
Des traitements par immunothérapie pour certains types de cancers (bloquant les points de contrôle immunitaires - « checkpoints » immunitaires) sont actuellement privilégiés pour établir une réponse anti-tumorale efficace.
Ce blocage se fait à l'aide d'anticorps thérapeutiques (immune checkpoint inhibitors), dont les plus connus sont les anti-PD1/PDL11. Malgré des résultats très encourageants, certains patients ne répondent pas aux immunothérapies actuelles. Il est possible que cela soit dû à la coexistence au sein de la tumeur de mécanismes multiples impliquant différents points de contrôle immunitaires tenant simultanément en échec la réponse immunitaire du patient, et rendant ainsi inefficace le ciblage thérapeutique d'un seul de ces mécanismes.
Les chercheurs du SRHI étudient depuis plusieurs années la molécule HLA-G, impliquée dans la tolérance du système immunitaire et particulièrement dans la tolérance fœto-maternelle. Cette protéine n'est exprimée dans un organisme sain que pendant la grossesse à la surface des cellules placentaires. Néanmoins, elle peut aussi s'exprimer dans certaines pathologies comme c'est le cas à la surface de certaines cellules tumorales. Les cellules cancéreuses utilisent HLA-G pour se protéger des défenses immunitaires de l'hôte, et ainsi se développer et récidiver. Ses effets immunosuppresseurs, déclenchés via son interaction avec les récepteurs ILT2/ILT4 présents à la surface des cellules immunitaires, pourraient expliquer la résistance aux immunothérapies actuelles. De plus, dans une étude précédente publiée par le SRHI, il a été montré que l'utilisation d'un anticorps anti-HLA-G dans un modèle préclinique murin permettait de restaurer une réponse anti-tumorale.
Dans ce contexte, l'objectif des travaux de recherche du SRHI est de démontrer qu'en cas de non-réponse aux thérapies anti-PD1/-PDL1, le checkpoint immunitaire HLA-G/ILT2/ILT4 constituerait une meilleure cible thérapeutique parmi les autres checkpoints. Et, par conséquence, que les anticorps anti-HLA-G pourraient être utilisés en tant qu'immunothérapie efficace en complément d'autres traitements.
Dans la dernière étude publiée dans Cancer Letters, afin de mieux comprendre l'impact de l'expression tumorale de HLA-G sur les lymphocytes T2 infiltrant la tumeur (TILs), les chercheurs du SRHI ont analysé les TILs de patients atteints de carcinome rénal à cellules claires (ccRCC).
Ils ont montré que les TILs CD8+ et CD4+ expriment également le récepteur ILT2 (ILT2+) avec lequel interagit HLA-G.
De façon intéressante, les patients ayant des lymphocytes T CD4+ ILT2+ au sein de la tumeur, en présentent moins en périphérie, témoignant ainsi d'une accumulation préférentielle de ces cellules dans le tissu tumoral. De plus, les TILs CD4+ ILT2+ expriment des marqueurs cytotoxiques tels que la perforine, KLRG1, GPR56, ou encore Tbet, habituellement retrouvés chez les lymphocytes T cytotoxiques CD8+ et NK (natural killer) impliqués dans l'apoptose des cellules cibles.
Les TILs CD4+ ILT2+ identifiés in situ sont également caractérisés par des marqueurs spécifiques (CD27- CD28- CCR7- CD45RA+) et une différenciation plus tardive, pouvant être ainsi apparentés à un sous-type de lymphocytes T à mémoire, les LT à effecteur de mémoire (TEM), plus efficaces et rapides dans la mise en place de la réponse immunitaire.
Au cours cette étude, les chercheurs décrivent également pour la première fois que les TILs CD4+ ILT2+ sont fonctionnellement cytotoxiques. Au contact de la molécule HLA-G, ils ont montré que ces TILs perdaient leur activité cytolytique, activité qui sera restaurée grâce au blocage de l'interaction HLA-G/IL2.
Le potentiel clinique de ces cellules a été confirmé par des analyses immunohistochimiques réalisées sur des échantillons de lésions tumorales de patients atteints de ccRCC montrant une co-localisation des cellules tumorales exprimant HLA-G (HLA-G+) dans des zones infiltrées par des cellules T CD4+.
Ainsi, ces résultats démontrent que les lymphocytes T CD4+ ILT2+ constituent un réservoir de cellules T cytotoxiques au sein de la tumeur, non ciblées par les inhibiteurs de checkpoints actuels, mais qui pourraient l'être par des anticorps bloquant l'interaction HLA-G/ILT2. Cette étude ouvre ainsi la voie à la mise en place d'une nouvelle alternative thérapeutique pour les tumeurs HLA-G+.
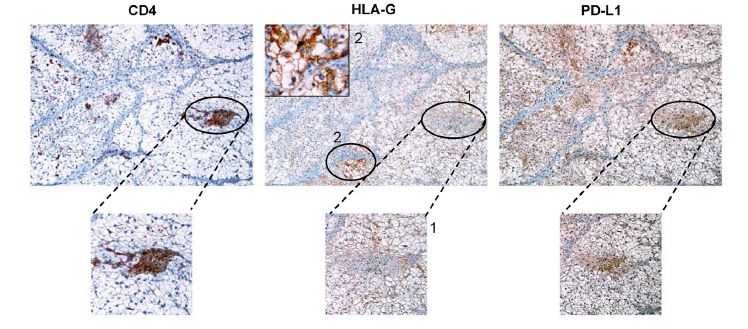
Analyse immunohistochimique de la co-expression des marqueurs CD4, HLA-G et PDL1 sur des coupes sériées de tissu tumoral provenant d’un patient avec un carcinome rénal à cellules claires (SRHI)
1 : Pour éviter que les cellules immunitaires comme les lymphocytes T, soient activées en continu et détruisent les cellules saines (comme dans le cas des maladies auto-immunes), elles sont munies de points de contrôle immunitaires - checkpoints immunitaires, que l'on peut assimiler à des cadenas, quand celui-ci est verrouillé par la bonne clé, les cellules immunitaires ne sont pas activées. Dans certains cas, les cellules tumorales ont la clé pour activer le cadenas des cellules immunitaires, les empêchant ainsi de détruire la tumeur. C'est le cas de PDL1 qui est exprimé par les cellules tumorales et qui peut 'verrouiller' PD1, récepteur présent à la surface des cellules immunitaires. Des chercheurs ont développé des anticorps anti-PD1 et anti-PDL1 (inhibiteurs de checkpoints immunitaires) pour éviter le « verrouillage » des lymphocytes T par les cellules tumorales, permettant ainsi leur activation contre les cellules tumorales pour les détruire.
2 : Les lymphocytes T (LT) jouent un rôle dans la réponse immunitaire adaptative, ils sont responsables de l'immunité cellulaire. Il existe plusieurs types de lymphocytes T, parmi eux : les LT CD8+, lymphocytes T cytotoxiques, qui détruisent les cellules cibles infectées par un virus ou transformées lors du processus de cancérogénèse ; les LT CD4+, lymphocytes T auxiliaires, qui sont des intermédiaires de la réponse immunitaire en régulant d'autres fonctions lymphocytaires.
Cette étude a été financée par l'INCA. Elle est le fruit d'une collaboration étroite entre les chercheurs du SRHI (CEA-Jacob), les oncologues, urologues et anatomo-pathologistes de l'hôpital Saint-Louis (Paris).