Le glioblastome humain est la tumeur cérébrale primitive1 la plus courante. Elle est particulièrement agressive et de très mauvais pronostic. Malgré un traitement de référence associant chirurgie, chimiothérapie et des séances répétées de radiothérapie, les récidives sont systématiques. Une sous-population de cellules cancéreuses, les cellules souches de glioblastome (CSG) semblent jouer un rôle majeur dans les rechutes, en résistant aux traitements. Ces cellules présentent des capacités régénératives comparables à celles des cellules souches neurales2 normales.
Des chercheurs de l'UMR Stabilité Génétique Cellules Souches et Radiations (IRCM / CEA-Jacob) se sont intéressés aux capacités migratoires des CSG en réponse aux radiations ionisantes. Ils montrent, dans un article publié dans la revue Scientific Reports, que les radiations ionisantes stimulent de façon spécifique les capacités migratoires et invasives des CSG humaines, et décryptent les mécanismes moléculaires sous-jacents.
Les chercheurs ont mené des expériences in vitro sur des CSG humaines isolées de plusieurs patients en utilisant différentes méthodes comme la vidéomicroscopie ou des tests d'invasion cellulaire, ainsi qu'in vivo dans un modèle murin de transplantation de CSG préalablement irradiées. Les résultats montrent que les radiations ionisantes, à des doses qui ne les tuent pas, stimulent les capacités migratoires des CSG, et que cette stimulation reste détectable plusieurs jours après l'irradiation.
Comment cela fonctionne-t-il ? Les chercheurs se sont penchés sur les mécanismes moléculaires impliqués, et ont démontré que les radiations ionisantes stimulent la migration des CSG via la voie de signalisation HIF1α / JMY. Ainsi, des expériences basées sur l'inactivation de gènes et l'utilisation d'inhibiteurs pharmacologiques ont permis de montrer que la migration des CSG en réponse aux radiations ionisantes s'accompagne d'une accumulation transitoire du facteur de transcription3 HIF1α (Hypoxia-Inducible Factor 1α) dans le noyau des cellules. De cette accumulation s'ensuit une augmentation de l'expression et de la production de la protéine JMY (Junction-mediating and regulatory protein), une des protéines cibles de HIF1α. La protéine JMY, notamment connue comme partenaire de la protéine p534, favorise également l'assemblage d'une classe de filaments du squelette cellulaire : les filaments d'actine. Et effectivement, les chercheurs du CEA ont bien observé une densification du réseau d'actine, strictement dépendante à la fois de HIF1α et JMY, dans les CSG en réponse aux radiations ionisantes. De plus, ils ont montré qu'une inactivation de la protéine JMY inhibe la migration radio-induite des CSG, confirmant ainsi l'implication de la voie moléculaire HIF1α / JMY dans ce phénomène.
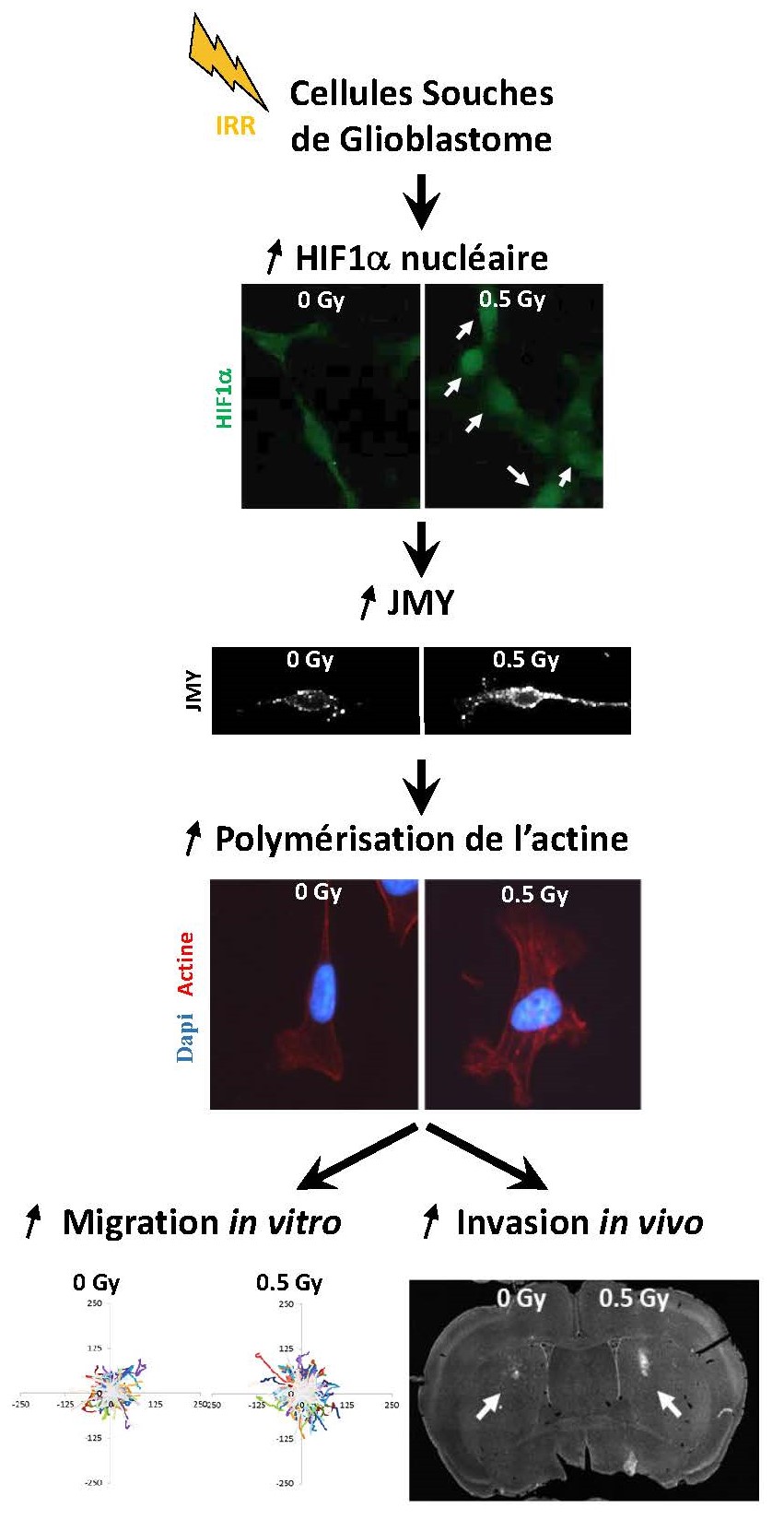
Dans les cellules
souches de glioblastome (CSG), les radiations ionisantes provoquent une
accumulation du facteur de transcription HIF1α dans le noyau (flèches blanches, en haut). Cela provoque une
augmentation de l'expression et de la production de la protéine JMY (au
milieu), qui entraîne à son tour une augmentation de la quantité et de la
polymérisation des filaments d'actine. Ces mécanismes moléculaires sont à
l'origine de la migration des CSG en réponse à des radiations ionisantes,
observées in vitro (en bas à gauche) et in vivo (en bas à droite). © L. Gauthier / F. Boussin
Les cellules ayant des caractéristiques de CSG sont très minoritaires au sein des tumeurs. Afin d'étudier les effets des radiations sur les cellules cancéreuses "non souches", des CSG ont été cultivées dans un milieu induisant leur différenciation, c'est-à-dire entraînant la perte de leurs caractéristiques de cellules souches. De manière remarquable, les radiations ionisantes se sont révélées incapables de stimuler la migration de ces cellules cancéreuses "différenciées", montrant que le mécanisme identifié est spécifique des CSG. En effet, la voie HIF1α / JMY n'est pas stimulée dans les cellules cancéreuses différenciées suite à une exposition à des radiations ionisantes.
Le traitement de référence du glioblastome comprend des séances journalières de radiothérapie répétées pendant plusieurs semaines. La stimulation de la migration pourrait permettre à certaines cellules cancéreuses de s'éloigner des zones irradiées et favoriser ainsi les rechutes ultérieures.
Le ciblage thérapeutique de HIF1α s'avère délicat en raison de son rôle dans la régulation de l'expression de très nombreux gènes. Agir à son niveau risquerait de conduire à de nombreux effets secondaires. En revanche, le ciblage de JMY pourrait fournir de nouvelles perspectives thérapeutiques pour prévenir la récidive tumorale après radiothérapie.
Ces travaux ont été financés par le CEA (segment radiobiologie), la
Ligue contre le Cancer,
EDF et la
Fondation de France. Une demande de brevet, couvrant l'utilisation d'inhibiteurs de JMY en traitement adjuvant contre le glioblastome, a été déposée.
1 Une tumeur primitive est la tumeur principale à partir de laquelle peuvent s'échapper des cellules cancéreuses qui vont former des métastases dans d'autres parties du corps.
2 Les cellules souches sont des cellules capables d'autorenouvellement, qui expriment des marqueurs spécifiques et peuvent se différencier en cellules spécialisées. Les cellules souches neurales donneront ainsi, après différenciation, les différents types cellulaires du tissu cérébral (neurones et cellules gliales).
3 Un facteur de transcription est une protéine qui se lie sur des séquences spécifiques d'ADN (dans le noyau de la cellule) pour initier ou réguler l'expression d'un gène, ce qui aura pour conséquence de réguler la production de la protéine (dans le cytoplasme de la cellule) codée par ce gène.
4 La protéine p53 est un facteur de transcription impliqué dans la régulation de très nombreuses fonctions cellulaires, comme la prolifération ou l'apoptose (mort programmée de la cellule). Dans plus de la moitié des cas de cancer chez l'Homme, le gène p53 présente une ou plusieurs mutation(s), ce qui lui vaut le surnom de "gène suppresseur de tumeurs".