Les néoplasies myéloprolifératives (NMPs) sont des maladies hématologiques rares. Ce sont des pathologies chroniques évoluant tout au long de la vie du patient et dont les complications vasculaires et hématologiques sont graves. La présence de mutations de plusieurs gènes, dont les gènes JAK2, MPL et CALR, représente une caractéristique majeure de ces maladies. Elles résultent d'interactions complexes déclenchant une phase de croissance initiale avec expansion clonale des lignées myéloïdes1, un syndrome inflammatoire et une fibrose de la moelle osseuse. Les NMPs dites « classiques » regroupent la leucémie myéloïde chronique (LMC), la polyglobulie de Vaquez (PV), la thrombocytémie essentielle (TE) et la myélofibrose primitive (MPF).
La myélofibrose (MF), qu'elle soit primitive ou secondaire2, se caractérise par un échec de la production de cellules sanguines par la moelle osseuse qui est progressivement envahie par des dépôts de fibres de réticuline et de collagène. La myélofibrose se traduit par une altération de l'état général du patient, avec l'observation d'un amaigrissement, de cytopénies, d'une anémie et d'une augmentation du volume de la rate (splénomégalie).
Les patients atteints de MF sévère présentent un mauvais pronostic avec une morbidité plus élevée liée à la maladie en raison de complications observées telles que la thrombose, l'hémorragie, les infections et l'évolution en leucémie aiguë, réduisant ainsi la survie à environ six ans. Les traitements actuels sont principalement palliatifs, orientés vers l'amélioration des symptômes, aucun traitement curatif n'existe en dehors de l'allogreffe de cellules souches sanguines de la moelle osseuse.
Dans l'objectif de trouver de nouvelles pistes thérapeutiques pour la MF, les chercheurs du laboratoire LCSAT (IDMIT) se sont intéressés à la voie PPAR-γ/STAT-5, s'inspirant de leurs travaux publiés précédemment sur le développement d'une thérapie ciblant la leucémie myéloïde chronique3.
Dans l'étude collaborative4 publiée dans Journal of Clinical Investigation , ils ont évalué la capacité d'agonistes (ligands) du récepteur nucléaire PPAR-γ à agir sur le développement de la myélofibrose. Les agonistes testés ont la particularité d'avoir une autorisation de mise sur le marché (AMM) : la pioglitazone, prescrit dans la prise en charge du diabète de type 2 (Actos®), et la mesalazine prescrit dans des pathologies impliquant une inflammation chronique (Pentasa®).
Les tests réalisés sur lignées cellulaires hématopoïétiques in vitro d'une part, et ex vivo sur cellules primaires de patients atteints de MF d'autre part, ont permis d'appréhender les mécanismes sous-tendant l'action antiproliférative de PPAR-γ sur les cellules progénitrices hématopoïétiques. Ces analyses ont ensuite été complétées avec des essais in vivo ciblant la prolifération des lignées myéloïdes dans trois modèles d'études précliniques murins de myélofibrose : le modèle de myélofibrose post-polyglobulie de Vaquez JAK2V617F, le modèle post-thrombocytémie essentielle ou modèle Calréticuline (CALRdel52) et le modèle TPOhigh.
Ces travaux ont montré qu'un traitement utilisant les agonistes de PPAR-γ prévenait la chute de l'hémoglobine5 associée au développement de la pathologie et limitait le remodelage de la moelle osseuse dans les modèles murins étudiés. L'action des agonistes de PPAR-γ passe par une réduction de la myéloprolifération6 (notamment via une diminution de l'activité STAT5), une modulation des cytokines de l'inflammation et une protection du stroma médullaire7 en bloquant l'activité du TGF-β, une cytokine majeure dans le développement de la fibrose.
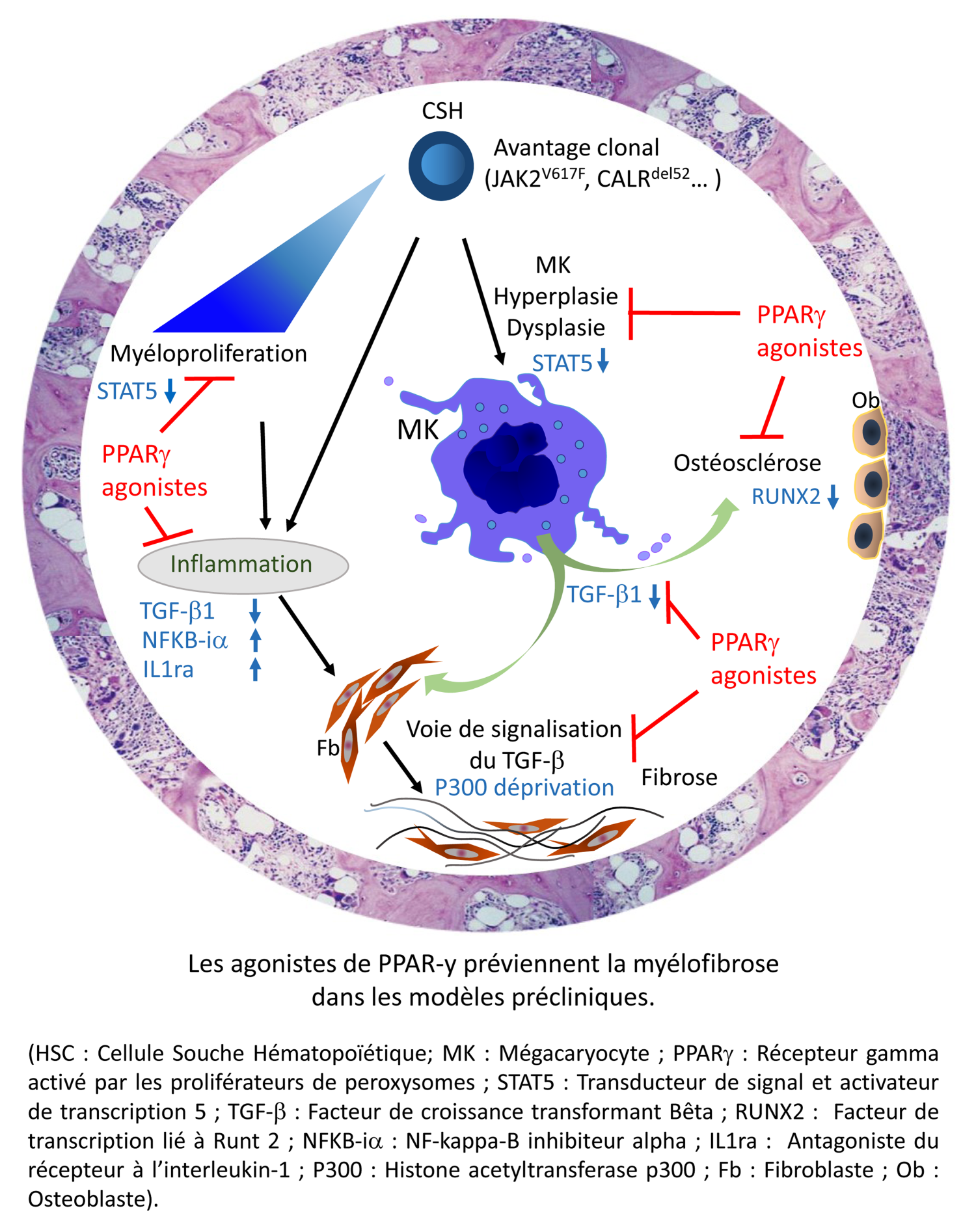
En agissant sur ces trois axes clés du développement de la myélofibrose, l'activation de PPAR-γ constitue une cible thérapeutique pertinente pour sa prise en charge et ces données soutiennent la possibilité d'utiliser des agonistes de PPAR-γ dans la pratique clinique.
Ces travaux ont été portés par l'équipe de S. Prost (LCSAT/IDMIT-IMVA1184/CEA-Jacob) intégrée au consortium OPALE labellisé Institut Carnot.
> Pour en savoir plus sur la labellisation Carnot :
Institut de biologie François Jacob - Labellisation Carnot : l'IDMIT et l'IRCM parmi les lauréats CEA
> Pour en savoir plus sur l'Institut Carnot OPALE :
https://www.instituts-carnot.eu/fr/institut-carnot/opale
1 : la moelle osseuse est le siège de la production des cellules sanguines à l'origine des différentes lignées cellulaires. Deux lignées dérivées des cellules souches hématopoïétiques sont à l'origine des futures cellules sanguines : les cellules myéloïdes et les cellules lymphoïdes. La lignée myéloïde donnera les plaquettes qui contribuent au processus de coagulation du sang, les globules rouges qui transportent l'oxygène, et deux types de globules blancs : les granulocytes et les monocytes qui jouent un rôle dans le système immunitaire en luttant contre les infections.
2 : consécutive à l'évolution d'une autre pathologie comme la thrombocytémie essentielle ou la polyglobulie de Vaquez
3 : Institut de biologie François Jacob - Une thérapie pour vaincre définitivement la leucémie myéloïde chronique (LMC) (cea.fr)
4 : en collaboration avec le Service d'hématologie et d'oncologie du centre hospitalier de Versailles, le Centre d'Investigations Cliniques de l'Hôpital Saint Louis (AP-HP), l'Institut de Génétique Moléculaire de Montpellier, l'Institut Gustave Roussy et le Service de Pharmacologie-Toxicologie de l'Hôpital Raymond Poincaré
5 : un des premiers signes de fibrose de la moelle osseuse est l'apparition d'une anémie qui se traduit par une réduction du taux d'hémoglobine dans le sang.
6 : prolifération clonale des progéniteurs hématopoïétiques et des cellules sanguines du lignage myéloïde
7 : le stroma médullaire constitue le tissu de soutien permettant la multiplication des cellules souches hématopoïétiques et leur différenciation en créant un microenvironnement adapté. Il est composé de cellules stromales (fibroblastes, adipocytes, ostéoblastes), d'un réseau microvasculaire (cellules endothéliales), et de leurs produits (matrice extracellulaire et facteurs de croissance hématopoïétiques).