Depuis la fin de l'année 2019, la pandémie de COVID-19 s'est propagée dans le monde entier, causant plus de cinq millions de décès et affectant environ 305 millions de personnes (1). Cette maladie, causée par la transmission du virus SARS-Cov-2, se manifeste par différents symptômes en fonction de la forme développée. Les formes légères se caractérisent principalement par de la fièvre, de la toux, de la fatigue, des pertes de goût (agueusie) et d'odorat (anosmie). Les formes les plus graves sont associées à un syndrome de détresse respiratoire aiguë, et une défaillance multiviscérale (défaillance de plusieurs organes) de très mauvais pronostic.
Des recherches intensives ont permis des progrès importants dans la compréhension des mécanismes sous-tendant les manifestations cliniques. Il a été démontré que l'activation des cellules endothéliales (cellules bordant les vaisseaux sanguins) jouait un rôle central dans la pathogenèse du syndrome de détresse respiratoire et de la défaillance multiviscérale chez les patients atteints de la COVID-19 (2,3). Cette activation endothéliale contribue à une infiltration accrue de neutrophiles immatures et/ou dysfonctionnels dans les tissus, notamment les poumons, conduisant à une forte réponse inflammatoire (orage cytokinique) dans les cas graves de COVID-19. Cependant, les mécanismes moléculaires sous-jacents à cette activation endothéliale restent encore mal définis.
Dans ce contexte, la molécule HLA-G, largement décrite pour son implication dans la tolérance fœto-maternelle, les réponses inflammatoires et infectieuses, est connue également pour ses propriétés anti-angiogéniques médiées via son interaction avec le récepteur CD160 exprimé par les cellules endothéliales. L'interaction entre HLA-G et CD160 induit l'apoptose des cellules endothéliales, inhibant le processus angiogénique (formation de vaisseaux sanguins) via la régulation négative du facteur de croissance des fibroblastes 2 (FGF-2). De plus, la molécule HLA-G est connue comme un puissant inhibiteur de l'adhésion des neutrophiles aux cellules endothéliales.
C'est dans ce contexte que le SRHI, qui étudie depuis plusieurs années la molécule HLA-G (4), a participé à un travail collaboratif avec des chercheurs de l'Université de Ferrara (Italie). Dans une étude publiée dans la revue Viruses, les équipes ont cherché à comprendre les mécanismes immunitaires et inflammatoires à l'origine des manifestations cliniques, et ce afin d'identifier des cibles thérapeutiques potentielles. Cette étude a montré pour la première fois, que des patients hospitalisés atteints de la COVID-19 avec une insuffisance respiratoire présentent des taux plasmatiques élevés de HLA-G soluble (sHLA-G), par rapport à des patients témoins hospitalisés pour insuffisance respiratoire non liée à la COVID-19 et à des témoins sains. Une corrélation a été observée entre les taux élevés de sHLA-G et une évolution favorable de la maladie chez les patients.
Afin d'étudier le lien entre la molécule soluble sHLA-G et l'activation des cellules endothéliales, deux biomarqueurs impliqués dans l'activation des cellules endothéliales ont été étudiés, la E-Sélectine et l'ICAM-1. Ces deux molécules sont impliquées dans l'adhésion des neutrophiles aux cellules endothéliales facilitant ainsi leur passage dans les tissus lors de la réaction inflammatoire.
Les résultats présentés dans cette étude, ont montré une corrélation inverse entre les niveaux plasmatiques de sHLA-G et les niveaux de ICAM-1 et E-Sélectine chez les patients atteints de la COVID-19.
Des expériences in vitro sur des cellules endothéliales activées (par des cytokines inflammatoires) ont confirmé la capacité de la molécule sHLA-G, via l'interaction avec le récepteur CD160, à diminuer l'expression des molécules ICAM-1 et E-Sélectine. Il a été observé une diminution de l'adhésion des neutrophiles aux cellules endothéliales avec une efficacité comparable à celle obtenue lors de l'utilisation d'anticorps bloquant ICAM-1 ou E-Sélectine sur le même modèle in vitro.
Des résultats similaires ont été obtenus avec des échantillons de plasmas de patients atteints de la COVID-19 en bonne voie de guérison et présentant des taux élevés de sHLA-G. L'inhibition de l'adhésion des neutrophiles aux cellules endothéliales obtenue avec les plasmas de patients COVID-19 a pu être significativement levée par le traitement d'anticorps anti-CD160, suggérant un rôle de l'interaction sHLA-G/CD160 dans la régulation de l'adhésion des neutrophiles aux cellules endothéliales. Ainsi, en diminuant l'expression des facteurs d'adhésion ICAM-1 et E-Sélectine sur les cellules endothéliales, moins de neutrophiles adhèrent aux parois des vaisseaux et migrent dans les tissus, diminuant les effets néfastes inflammatoires qui s'en suivent.
En conclusion, les données obtenues suggèrent que la forme soluble de HLA-G (sHLA-G) aurait des propriétés anti-inflammatoires significatives en contrôlant l'adhésion des neutrophiles à l'endothélium activé, améliorant ainsi l'évolution de la maladie chez les patients atteints de la COVID-19. Ainsi, des niveaux élevés de sHLA-G dans le sang des patients COVID-19 représenteraient un nouveau biomarqueur prometteur de l'évolution de la maladie. Des recherches sont maintenant nécessaires pour évaluer les mécanismes par lesquels HLA-G contrôle l'expression d'ICAM-1 et de la E-Sélectine par les cellules endothéliales activées et comment elle agit sur l'adhésion des neutrophiles.
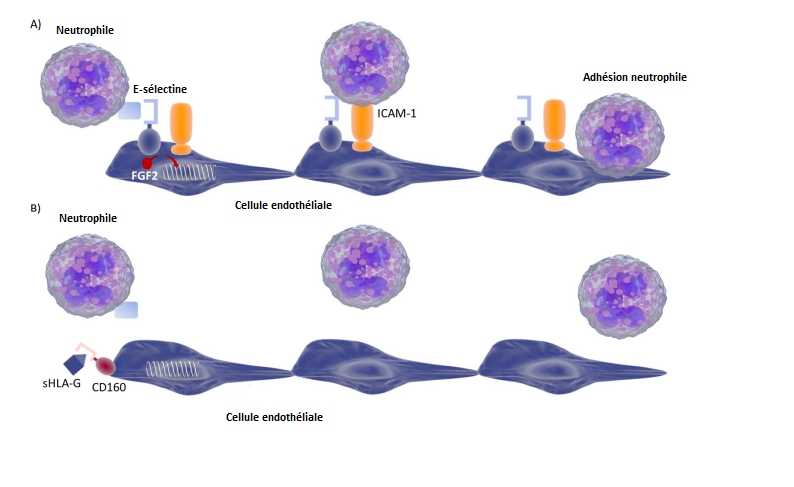
Représentation schématique des interactions moléculaires impliquées dans l’adhésion des cellules neutrophiles aux cellules endothéliales et du rôle de HLA-G dans le blocage de ces interactions. (A) Les leucocytes circulants, dont les neutrophiles, pénètrent dans les tissus inflammatoires par des événements séquentiels d’adhésion et de signalisation. Les neutrophiles s'attachent d'abord et roulent sur la E-Sélectine exprimée sur les cellules endothéliales activées, ce qui permet des interactions avec ICAM-1 qui favorisent l'arrêt, le renforcement de l'adhésion, et la migration trans-endothéliale des neutrophiles vers les tissus. Il est important de noter que la E-Sélectine déclenche directement des signaux au niveau des neutrophiles « roulants » augmentant leur recrutement pendant l'inflammation. Ainsi, les neutrophiles interagissent avec les molécules E-Sélectine et ICAM-1 présentes sur les cellules endothéliales permettant ainsi leur adhésion à l’endothélium et leur migration du sang vers les tissus. (B) Lors de la COVID-19, il y a une augmentation de production des molécules solubles sHLA-G dans le sang, lesquelles interagissent avec le récepteur CD160 présent sur les cellules endothéliales. Cette interaction entre sHLA-G et CD160 conduit à l’inhibition de l’expression de la E-Sélectine et d’ICAM-1 réduisant ainsi l’adhésion des neutrophiles aux cellules endothéliales. Cette diminution d’adhésion des neutrophiles à l’endothélium pourrait améliorer les manifestations cliniques des patients COVID en diminuant la réaction inflammatoire observée dans les formes sévères de la maladie. (Crédit image: SRHI)